Закон электролиза в жидкостях
Оглавление:
Электрический ток в жидкостях
Жидкости, как и любые другие вещества, могут быть проводниками, полупроводниками и диэлектриками. Например, дистиллированная вода будет являться диэлектриком, а растворы и расплавы электролитов будут являться проводниками. Полупроводниками будут являться, например, расплавленный селен или расплавы сульфидов.
Ионная проводимость
Электролитическая диссоциация — это процесс распадения молекул электролитов на ионы под действием электрического поля полярных молекул воды. Степенью диссоциации называется доля молекул распавшихся на ионы в растворенном веществе.
Степень диссоциации будет зависеть от различных факторов: температура, концентрация раствора, свойства растворителя. При увеличении температуры, степень диссоциации тоже будет увеличиваться.
После того как молекулы разделились на ионы, они движутся хаотично. При этом два иона разных знаков могут рекомбинироваться, то есть снова объединиться в нейтральные молекулы. При отсутствии внешних изменений в растворе должно установиться динамическое равновесие. При нем число молекул которое распалось на ионы за единицу времени, будет равняться числу молекул, которые снова объединятся.
Носителями зарядов в водных растворах и расплавах электролитов будут являться ионы. Если сосуд с раствором или расплавом включить в цепь, то положительно заряженные ионы начнут двигаться к катоду, а отрицательные – к аноду. В результате этого движения возникнет электрический ток. Данный вид проводимости называют ионной проводимостью.
Помимо ионной проводимости в жидкостях может обладать и электронной проводимостью. Такой тип проводимости свойственен, например, жидким металлам. Как отмечалось выше, при ионной проводимости прохождение тока связано с переносом вещества.
Электролиз
Вещества которые входят в состав электролитов, будут оседать на электродах. Этот процесс называется в электролизом. Электролиз – процесс выделения на электроде вещества, связанный с окислительно-восстановительными реакциями.
Электролиз нашел широкое применение в физике и технике. С помощью электролиза поверхность одного металла покрывают тонким слоем другого металла. Например, хромирование и никелирование.
С помощью электролиза можно получить копию с рельефной поверхности. Для этого необходимо, чтобы слой металла, который осядет на поверхности электрода, легко можно было снять. Для этого иногда на поверхность наносят графит.
Процесс получения таких легко отслаиваемых покрытий получил название гальвано-пластика. Этим метод разработал русский ученый Борис Якоби при изготовлении полых фигур для Исаакиевского собора с Санкт-Петербурге.
Еще одним способом применения электролиза является получение чистого металла из примесей. С помощью электролиза изготавливают печатные платы для различных цифровых устройств.
www.nado5.ru
Закон электролиза в жидкостях
§ 46. ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХ. ЗАКОН ЭЛЕКТРОЛИЗА ФАРАДЕЯ.
Прохождение тока через электролит сопровождается химическими реакциями на электродах, в результате которых выделяются элементы, входящие в состав электролита.
Жидкости, как и твёрдые тела, могут проводить электрический ток. Если переносчиками тока в жидкости служат ионы, то её проводимость называют ионной, а такую жидкость – электролитом.
Ионы при растворении вещества появляются из-за того, что ещё до растворения у многих молекул одна часть обладает избыточным числом электронов, а в другой части их не хватает. Такая молекула, бывшая до растворения электрически нейтральной, при растворении распадается (диссоциирует) на два иона, заряженные равными по модулю, но противоположными по знаку зарядами. Способствуют этому процессу, названному электролитической диссоциацией, полярные молекулы растворителя (например, воды), разрывающие на части (ионы) молекулы растворённого вещества.
Одновременно с электролитической диссоциацией идёт процесс рекомбинации – образование из ионов нейтральных молекул растворённого вещества. Если условия, в которых находится электролит, остаются неизменны, то скоро наступает момент, когда число молекул, распадающихся на ионы в единицу времени, становится равным числу молекул, образовавшихся из ионов в процессе рекомбинации. Таким образом, наступает динамическое равновесие между диссоциацией и рекомбинацией, при котором концентрац ия ио нов остаётся постоянной. При росте температуры динамическое равновесие смещается в сторону электролитической диссоциации и концентрац ия ио нов в электролите растёт.
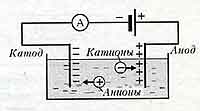
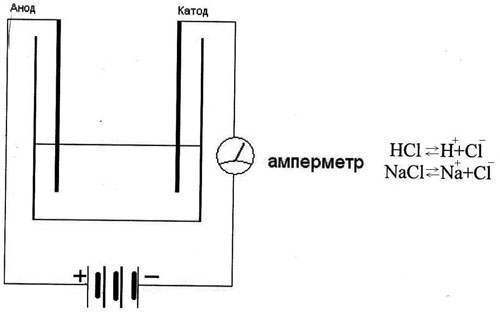
Положительные и отрицательн ые ио ны в электролите способны перемещаться независимо друг от друга, участвуя, например, в тепловом движении (рис. 46а). Однако при таком беспорядочном движен ии ио нов ток через электролит остаётся равным нулю. Для пропускания тока через электролит в него погружают проводники (рис. 46б), которые называют электродами, создавая с их помощью в электролите электрическое поле. При этом положительный электрод называют анодом, а отрицательный – катодом. Когда между электродами возникает разность потенциалов, движен ие ио нов становится упорядоченным: отрицательные ионы движутся к аноду, а положительные – к катоду.
В отличие от электронной , ионная проводимость сопровождается, переносом вещества ( ионов ). Соприкасаясь с катодом, положительн ые ио ны получают от него недостающие электроны и становятся электрически нейтральными. При соприкосновении отрицательных ионов с анодом они теряют лишние электроны и тоже становятся нейтральными атомами или молекулами. Таким образом, ток, проходя через электролит, приводит к выделению на электродах веществ, входящих в состав электролита. Это явление и сопровождающий его процесс разложения электролита при пропускании электрического тока называют электролиз ом.
Впервые электролиз исследовал М. Фарадей, который экспериментально доказал, что масса, выделяющегося на электроде вещества, пропорциональна величине заряда, протекающего через электролит. Это заключение называют законом электролиза Фарадея, который сейчас можно легко вывести теоретически. Пусть в электролите присутствуют положительные и отрицательн ые ио ны с валентностью n . Тогда заряд каждого положительного иона будет равен ne ( e – элементарный заряд). Если при электролизе через электролит прошёл заряд q , то очевидно, что число N положительных ионов, достигших катода равно:
Каждый из положительных ионов, соприкоснувшись с катодом, превращается в нейтральную молекулу (или атом). Если молярная масса вещества, выделяющегося на катоде равна M , то масса m i одной молекулы, ставшей нейтральной на катоде, равна:
где N A — постоянная Авогадро. Из (46.1) и (46.2) следует, что масса m вещества, выделившегося на катоде, равна:
kaf-fiz-1586.narod.ru
ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХ
Жидкости по степени электропроводности делятся на:
диэлектрики (дистиллированная вода),
проводники (электролиты),
полупроводники (расплавленный селен).
— это проводящая жидкость (растворы кислот , щелочей, солей и расплавленные соли).
Электролитическая диссоциация
(разъединение)
— при растворении в результате теплового движения происходят столкновения молекул растворителя и нейтральных молекул электролита.
Молекулы распадаются на положительные и отрицательные ионы.
Например, растворение медного купороса в воде.
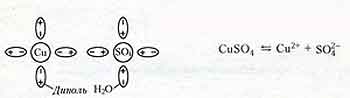
Ион
— атом или молекула, потерявшая или присоединившая к себе один или несколько электронов;
— существуют положительные ( катионы ) и отрицательные ( анионы ) ионы.
Рекомбинация ионов
Наряду с диссоциацией в электролите одновременно может происходить процесс восстановления ионов в нейтральные молекулы.
Между процессами электролитической диссоциации и рекомбинации при неизменных условиях устанавливается динамическое равновесие.
Степень диссоциации
— доля молекул, распавшихся на ионы;
— возрастает с увеличением температуры;
— еще зависит от концентрации раствора и от электрических свойств растворителя.
Электропроводимость электролитов
Ионная проводимость — упорядоченное движение ионов под действием внешнего эл.поля; существует в электролитах; прохождение эл.тока связано с переносом вещества.
Электронная проводимость — также в небольшой мере присутствует в электролитах , но в основном характеризует электропроводимость жидких металлов.
Ионы в электролите движутся хаотически до тех пор, пока в жидкость не опускаются электроды, между которыми существует разность потенциалов. Тогда на хаотическое движение ионов накладывается их упорядоченное движение к соответствующим электродам и в электролите возникает эл. ток.

Зависимость сопротивления электролита от температуры
Температурная зависимость сопротивления электролита объясняется в основном
изменением удельного сопротивления.
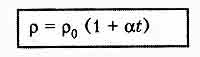 ,
,
где альфа — температурный коэффициент сопротивления.
Для электролитов всегда
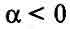
Поэтому
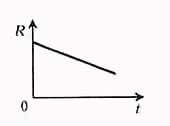
Сопротивление электролита можно рассчитать по формуле:
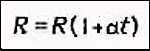
Явление электролиза
— сопровождает прохождение эл.тока через жидкость;
— это выделение на электродах веществ, входящих в электролиты;
Положительно заряженные анионы под действием электрического поля стремятся к отрицательному катоду, а отрицательно заряженные катионы — к положительному аноду.
На аноде отрицательные ионы отдают лишние электроны ( окислительная реакция )
На катоде положительные ионы получают недостающие электроны ( восстановительная реакция ).
Закон электролиза
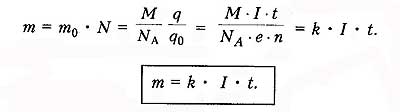
Закон электролиза определяет массу вещества, выделяемого на электроде при электролизе за время прохождения эл.тока .
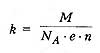
k — электрохимический эквивалент вещества, численно равный массе вещества, выделившегося на электроде при прохождении через электролит заряда в 1 Кл.
Зная массу выделившегося вещества, можно определить заряд электрона.

Применение электролиза
получение чистых металлов (очистка от примесей);
гальваностегия, т.е. получение покрытий на металле ( никелирование, хромирование и т.д. );
гальванопластика, т.е. получение отслаиваемых покрытий ( рельефных копий).
Другие страницы по теме «Электричество» за 10-11 класс:
class-fizika.narod.ru
Конспект урока физики на тему «Электрический ток в жидкостях, закон электролиза, применение»
Разделы: Физика
Цели: Разъяснить физическую природу электропроводности жидких проводников, осуществить вывод закона электролиза в свете электронных представлений, научить учащихся применять закон при решении задач.
Комплексное методическое обеспечение:
- приборы для демонстрации опыта,
- дополнительная литература,
- учебник физики 10 кл.,
- портреты ученых: Б.С. Якоби, М.М. Фарадей
1. Вступительное слово преподавателя
С электропроводностью растворов солей в воде связано очень многое в нашей жизни.
С первого удара сердца (“живое” электричество в теле человека, на 80% состоящем из воды) до автомобилей на улице, плееров и мобильных телефонов (неотъемлемой частью этих устройств являются “батарейки” — электрохимические элементы питания и различные аккумуляторы — от свинцово-кислотных в автомобилях до литий-полимерных в самых дорогих мобильных телефонах”. В огромных, дымящихся ядовитыми парами чанах из расплавленного при огромной температуре боксита электролизом получают алюминий — “крылатый” металл для самолетов и банок для “фанты”. Все вокруг — от хромированной решетки радиатора иномарки до посеребренной сережки в ухе когда-либо сталкивалось с раствором или расплавом солей. А, следовательно, с электрическим током в жидкостях. Не зря это явление изучает целая наука — электрохимия, но нас сейчас больше интересуют физические основы этого явления
2. Демонстрация опыта:
Дистилированная вода не проводит ток в собранной установке. Лампочка не загорается, а если добавим в эту воду немного кислоты или соли, то в цепи появится ток и лампочка загорит. Происходит распад молекулы на (+) и (-) ионы, электролитическая диссоциация (связь с химией).
“Атомы вещества каким-то образом одарены электрическими силами или связаны с ними, и им они обязаны своими наиболее замечательными качествами.” (М. Фарадей)
Вывод: электронная и ионная проводимость растворов
Электрический ток в растворах и расплавах электролитов приводит к выделению на электродах веществ, входящих в состав электролита. Это явление называется электролизом и в 1800 году его открыли английские ученые У. Никольсон и А. Карлей, а исследовал — английский физик М. Фарадей в 1834 году, он также ввел термины: катод, электроды, анод, электролиз, электролиты.
4. Закон Фарадея (1843 год)
Масса вещества, выделившегося на электроде за время при прохождении электрического тока, пропорциональна силе тока и времени, где 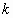 — электрохимический эквивалент вещества.
— электрохимический эквивалент вещества.
“Электролиз важно знать, чтобы массу рассчитать, которая в растворе выделяется, когда в нем токи появляются. Пусть в растворе будет медный купорос, на катоде видим меди прирост. Масса меди будет больше при том, если токи больше времени в нем. Не простой ведь он, Фарадея, англичанина закон”.
5. Применение электролиза (работа по учебнику)
а) электролитический метод получения чистых металлов (рафинирование). Хорошим примером является электролитическое очищение меди, драгоценных металлов — золото и серебро.
б) посредством электролиза можно покрыть металлические предметы слоем другого металла. Этот процесс называется гальваностегией. Особое техническое значение имеют покрытия трудноокисляемыми металлами: никелирование и хромирование.
в) гальванопластика- изготовление рельефной копии предмета. Этот процесс был разработан русским ученым Б. С. Якоби (1801-1874 г.), который в 1836 году применил этот способ для изготовления полых фигур для Исаакиевского собора в Санкт-Петербурге
г) получение оксидных защитных пленок на металлах (анодирование)
д) электрохимическая обработка поверхности металлического изделия (полировка)
е) электрохимическое окрашивание металлов (медь, латунь, цинк)
ж) очистка воды – удаление из нее растворимых примесей, в результате получается так называемая мягкая вода
з) электрохимическая заточка режущих инструментов (хирургические ножи, бритвы)
6. Сообщение: биография М. Фарадея.

Фарадей Майкл (1791-1867) — английский физик, основоположник учения об электромагнитном поле, иностранный почетный член Петербургской А. Н.(1830). Обнаружил химическое действие электрического тока, взаимосвязь между электричеством и магнетизмом, магнетизмом и светом. Открыл (1831 г) электромагнитную индукцию-явление, которое легло в основу электротехники. Установил (1833-1834 г.) законы электролиза, открыл пара- и диамагнетизм, вращение плоскости поляризации света в магнитном поле. Даже далеко не полный перечень того, что внес в науку Фарадей, дает представление об исключительном значении его трудов.
Точка зрения на электродинамику с позиций концепции поля, основоположником которой был Фарадей, стала неотъемлемой частью современной науки. Труды Фарадея ознаменовали наступление новой эры в физике.
7. Сообщение: Якоби Борис Семенович (Мориц Герман) (1801-1874 г.)

Российский физик и электротехник, академик Петербургской А Н(1842г), родился в Германии, с 1835 г проживал в России. Много трудов по практическому применению электричества, изобрел электродвигатель(1834г) и опробовал его для привода судна (1838г). Создал гальванотехнику(1838г), несколько типов телеграфных аппаратов (1840-1850г) Исследовал электромагниты совместно с Э. Х. Ленцем. Труды по военной электротехнике, электрическим измерениям, метеоролог.
8. Решение задач (устно):
1) Почему нельзя прикасаться к неизолированным электрическим проводам голыми руками? (Влага на руках всегда содержит раствор различных солей и является электролитом поэтому создает хороший контакт между проводами и кожей)
2) Почему для гальванического покрытия изделия чаще используют никель и хром? (большая химическая стойкость, механическая прочность и после полировки дают красивый блеск)
3) Почему провода осветительной сети обязательно имеют резиновую оболочку, а провода, предназначенные для сырых помещений кроме того, еще просмолены снаружи?
(так как влага на проводах представляет электролит и является проводником, а это может привести к короткому замыканию и пожару)
4) (письменно) с комментариями у доски упр. 20 (4,5,7) стр.343-344 физика-10 Г.Я.Мякишев
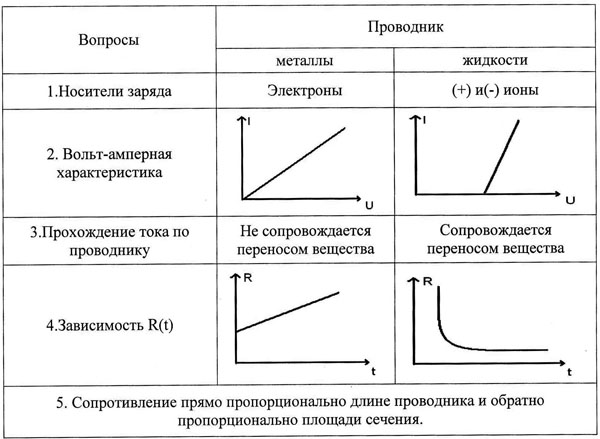
9. Заполнение таблицы: “Сходства и различия в электропроводности металлов и жидкостей”.
10. Подведение итогов урока, выставление оценок.
xn--i1abbnckbmcl9fb.xn--p1ai
Электрический ток в жидкостях. Закон электролиза
«Физика — 10 класс»
Каковы носители электрического тока в вакууме?
Каков характер их движения?
Жидкости, как и твёрдые тела, могут быть диэлектриками, проводниками и полупроводниками. К диэлектрикам относится дистиллированная вода, к проводникам — растворы и расплавы электролитов: кислот, щелочей и солей. Жидкими полупроводниками являются расплавленный селен, расплавы сульфидов и др.
Электролитическая диссоциация.
При растворении электролитов под влиянием электрического поля полярных молекул воды происходит распад молекул электролитов на ионы.
Распад молекул на ионы под влиянием электрического поля полярных молекул воды называется электролитической диссоциацией.
Степень диссоциации — доля в растворённом веществе молекул, распавшихся на ионы.
Степень диссоциации зависит от температуры, концентрации раствора и электрических свойств растворителя.
С увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов.
Ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы.
При неизменных условиях в растворе устанавливается динамическое равновесие, при котором число молекул, распадающихся за секунду на ионы, равно числу пар ионов, которые за то же время вновь объединяются в нейтральные молекулы.
Ионная проводимость.
Носителями заряда в водных растворах или расплавах электролитов являются положительно и отрицательно заряженные ионы.
Если сосуд с раствором электролита включить в электрическую цепь, то отрицательные ионы начнут двигаться к положительному электроду — аноду, а положительные — к отрицательному — катоду. В результате по цепи пойдёт электрический ток.
Проводимость водных растворов или расплавов электролитов, которая осуществляется ионами, называют ионной проводимостью.
Жидкости могут обладать и электронной проводимостью. Такой проводимостью обладают, например, жидкие металлы.
Электролиз. При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в состав электролитов. На аноде отрицательно заряженные ионы отдают свои лишние электроны (в химии это называется окислительной реакцией), а на катоде положительные ионы получают недостающие электроны (восстановительная реакция).
Процесс выделения на электроде вещества, связанный с окислительновосстановительными реакциями, называют электролизом.
От чего зависит масса вещества, выделяющегося за определённое время? Очевидно, что масса m выделившегося вещества равна произведению массы m0i одного иона на число Ni ионов, достигших электрода за время Δt:
Масса иона m0i равна:

где М — молярная (или атомная) масса вещества, a NA — постоянная Авогадро, т. е. число ионов в одном моле.
Число ионов, достигших электрода, равно:

где Δq = IΔt — заряд, прошедший через электролит за время Δt; q0i — заряд иона, который определяется валентностью n атома: q0i = пе (е — элементарный заряд). При диссоциации молекул, например КВr, состоящих из одновалентных атомов (n = 1), возникают ионы К + и Вr — . Диссоциация молекул медного купороса ведёт к появлению двухзарядных ионов Си 2+ и SO 2- 4 (n = 2). Подставляя в формулу (16.3) выражения (16.4) и (16.5) и учитывая, что Δq = IΔt, a q0i = nе, получаем

Закон Фарадея.
Обозначим через k коэффициент пропорциональности между массой m вещества и зарядом Δq = IΔt, прошедшим через электролит:

где F = eNA = 9,65 • 10 4 Кл/моль — постоянная Фарадея.
Коэффициент k зависит от природы вещества (значений М и n). Согласно формуле (16.6) имеем
Закон электролиза Фарадея:
Масса вещества, выделившегося на электроде за время Δt. при прохождении электрического тока, пропорциональна силе тока и времени.
Это утверждение, полученное теоретически, впервые было установлено экспериментально Фарадеем.
Величину k в формуле (16.8) называют электрохимическим эквивалентом данного вещества и выражают в килограммах на кулон (кг/Кл).
Из формулы (16.8) видно, что коэффициент к численно равен массе вещества, выделившегося на электродах, при переносе ионами заряда, равного 1 Кл.

Электрохимический эквивалент имеет простой физический смысл. Так как M/NA = m0i и еn = q0i, то согласно формуле (16.7) k = rn0i/q0i, т. е. k — отношение массы иона к его заряду.
Измеряя величины m и Δq, можно определить электрохимические эквиваленты различных веществ.
Убедиться в справедливости закона Фарадея можно на опыте. Соберём установку, показанную на рисунке (16.25). Все три электролитические ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, различны. Обозначим силы токов через I1, I2, I3. Тогда I1 = I2 + I3. Измеряя массы m1, m2, m3 веществ, выделившихся на электродах в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам токов I1, I2, I3.
Определение заряда электрона.
Формулу (16.6) для массы выделившегося на электроде вещества можно использовать для определения заряда электрона. Из этой формулы вытекает, что модуль заряда электрона равен:

Зная массу m выделившегося вещества при прохождении заряда IΔt, молярную массу М, валентность п атомов и постоянную Авогадро NA, можно найти значение модуля заряда электрона. Оно оказывается равным e = 1,6 • 10 -19 Кл.
Именно таким путём и было впервые в 1874 г. получено значение элементарного электрического заряда.
Применение электролиза. Электролиз широко применяют в технике для различных целей. Электролитическим способом покрывают поверхность одного металла тонким слоем другого (никелирование, хромирование, позолота и т. п.). Это прочное покрытие защищает поверхность от коррозии. Если обеспечить хорошее отслаивание электролитического покрытия от поверхности, на которую осаждается металл (этого достигают, например, нанося на поверхность графит), то можно получить копию с рельефной поверхности.
Процесс получения отслаиваемых покрытий — гальванопластика — был разработан русским учёным Б. С. Якоби (1801—1874), который в 1836 г. применил этот способ для изготовления полых фигур для Исаакиевского собора в Санкт-Петербурге.
Раньше в полиграфической промышленности копии с рельефной поверхности (стереотипы) получали с матриц (оттиск набора на пластичном материале), для чего осаждали на матрицы толстый слой железа или другого вещества. Это позволяло воспроизвести набор в нужном количестве экземпляров.
При помощи электролиза осуществляют очистку металлов от примесей. Так, полученную из руды неочищенную медь отливают в форме толстых листов, которые затем помещают в ванну в качестве анодов. При электролизе медь анода растворяется, примеси, содержащие ценные и редкие металлы, выпадают на дно, а на катоде оседает чистая медь.
При помощи электролиза получают алюминий из расплава бокситов. Именно этот способ получения алюминия сделал его дешёвым и наряду с железом самым распространённым в технике и быту.
С помощью электролиза получают электронные платы, служащие основой всех электронных изделий. На диэлектрик наклеивают тонкую медную пластину, на которую наносят особой краской сложную картину соединяющих проводов. Затем пластину помещают в электролит, где вытравливаются не закрытые краской участки медного слоя. После этого краска смывается, и на плате появляются детали микросхемы.
Источник: «Физика — 10 класс», 2014, учебник Мякишев, Буховцев, Сотский
Электрический ток в различных средах — Физика, учебник для 10 класса — Класс!ная физика
class-fizika.ru
