Термохимические законы и реакции
2.7. Теплота реакции. Закон Гесса
Разрыв и образование химических связей в ходе реакции сопровождается изменением энергии системы. Разница в энергиях связей в продуктах реакции и исходных веществах составляет энергию химической реакции, в том числе ее теплоту.
Нередко понятия «теплота реакции» и «энергия реакции» используются как тождественные, хотя они имеют различный смысл. Теплота — один из видов энергии. При химической реакции может происходить выделение (поглощение) энергии и в других видах (электрическая, механическая, световая энергия). Теплота (тепловой эффект) реакции — это количество тепловой энергии, выделившееся или поглощенное системой в результате протекающих в ней химических превращений.
Тепловой эффект обозначается символами Q или ΔH (Q = -ΔH). Реакции, идущие с выделением теплоты (Q > 0; ΔH 0) — к эндотермическим. Уравнение реакции с указанием ее теплового эффекта называется термохимическим. Например:
Если теплоту реакции отнести к 1 моль определенного вещества, то в термохимическом уравнении некоторые стехиометрические коэффициенты могут быть дробными. Например:
C6H6(ж) + 7,5O2 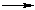 6CO2(г) + 3H2O + 3301,6 кДж/моль На теплоту образования веществ влияет их агрегатное и фазовое. Поэтому в термохимических уравнениях принято указывать это состояние (г — газ, ж — жидкость, т — твердое вещество, к — кристаллическая фаза).
6CO2(г) + 3H2O + 3301,6 кДж/моль На теплоту образования веществ влияет их агрегатное и фазовое. Поэтому в термохимических уравнениях принято указывать это состояние (г — газ, ж — жидкость, т — твердое вещество, к — кристаллическая фаза).
В основе термохимических расчетов лежит закон постоянства количества теплоты, открытый русским химиком Г.И. Гессом в 1840 г. Тепловой эффект реакции зависит только от начального и конечного состояний реагирующих веществ и не зависит от пути реакции (т.е. от числа стадий и промежуточных состояний).
Этот закон является следствием всеобщего закона сохранения энергии. Согласно закону Гесса, теплота химической реакции равна разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ:
Qреакции = ΣQобр.(продуктов) ΣQобр.(исх.веществ) где Qобр. – теплота образования 1 моль соединения из простых веществ в стандартных условиях (Т = 298 К, p = 101,3 кПа).
Величину Qобр. = -ΔH o обр. называют стандартной молярной теплотой (энтальпией) образования вещества.
Стандартные теплоты образования простых веществ в наиболее устойчивой модификации (О2, Н2, Сграфит и т.п.) приняты равными нулю.
Закон Гесса позволяет рассчитать тепловые эффекты любых промежуточных (в том числе, гипотетических) стадий на пути превращения реагента в продукт реакции.
orgchem.ru
Первый закон термохимии (Лавуазье и Лаплас, 1780—1784):
тепловой эффект образования данного соединения в точности равен, но обратен по знаку тепловому эффекту его разложения.
Из закона Лавуазье—Лапласа следует невозможность построить вечный двигатель I рода, использующий энергию химических реакций.
Второй закон термохимии (Г. И. Гесс, 1840):
тепловой эффект химической реакции не зависит от характера и последовательности отдельных ее стадий и определяется только начальными и конечными продуктами реакции и их физическим состоянием (при p = const или при v = const ).
Г. И. Гесс первый принял во внимание физическое состояние реагирующих веществ, так как теплоты изменения агрегатных состояний веществ накладываются на тепловой эффект реакции, увеличивая или уменьшая его.
Утверждение закона Гесса о том, что тепловой эффект процесса не зависит от его отдельных стадий и их последовательности, дает возможность рассчитывать тепловые эффекты реакций для случаев, когда их определить экспериментально или очень трудно, или вообще невозможно.
Применение закона Гесса чрезвычайно расширило возможности термохимии, позволяя производить точные расчеты тепловых эффектов образования целого ряда веществ, опытные данные по которым получить было трудно.
Закон Гесса в наши дни применяют главным образом для расчета термодинамических функций—энтальпий, которые сейчас используются для термохимических расчетов. Термохимия, исторически сложившаяся раньше термодинамики, в настоящее время претерпела некоторые изменения и стала разделом химической термодинамики.
pipec8.narod.ru
Раздел химии, который посвящен количественному определению тепловых эффектов химических реакций, называется термохимией.
Расчет тепловых эффектов реакций, в частности при p = const, основан на двух законах термохимии.
 первый закон термохимии: при разложении соединения на простые вещества происходит изменение энтальпии, равное (но с противоположным знаком) изменению энтальпии при образовании этого соединения из тех же простых веществ
первый закон термохимии: при разложении соединения на простые вещества происходит изменение энтальпии, равное (но с противоположным знаком) изменению энтальпии при образовании этого соединения из тех же простых веществ
Первый закон тeрмохимии открыт в конце XVIII в. французскими учеными Лавуазье и Лапласом, второе название этого закона — закон Лавуазье-Лапласа. Фактически этот закон вытекает из закона сохранения энергии; именно на этом законе основана формула для расчета энтальпии реакции по энтальпии образования участвующих в ней веществ.
Энтальпию образования определить экспериментально можно не для всех веществ из-за сложности проведения или практической неосуществимости многих реакций.  Табличные значения ΔH°298 для многих веществ получены расчетным способом, основанном на втором законе термохимии, открытом в 1840 г. русским химиком Г.И. Гессом , закон Гесса:
Табличные значения ΔH°298 для многих веществ получены расчетным способом, основанном на втором законе термохимии, открытом в 1840 г. русским химиком Г.И. Гессом , закон Гесса:
второй закон термохимии: сумма энтальпий двух или более промежуточных реакций (стадий) при переходе от исходного состояния к конечному состоянию равна энтальпии реакции, которая непосредственно ведет от исходного состояния к конечному состоянию
Таким образом, энтальпия реакции зависит только от вида и состояния реагентов, но не зависит от промежуточных состояний и пути перехода от реагентов к продуктам (это вторая формулировка закона Гесса). Закон Гесса позволяет связать энтальпийные эффекты процесса, который может протекать в одну или несколько стадий, и тем самым рассчитать энтальпию (тепловой эффект) той реакции, которую трудно осуществить или довести до конца.
Пример. Процесс образования диоксида углерода при сжигании графита в кислороде может протекать двумя путями:
- 2C + O2 = 2CO
2CO + O2 = 2CO2 - C + O2 = CO2
Экспериментально определить энтальпию образования CO по первой реакции невозможно, т.к. идет вторая реакция — превращение CO в CO2. Однако можно экспериментально определить энтальпию реакции превращений CO в CO2 если получить (каким-либо другим способом) чистый CO, а затем перевести его в CO2 сжиганием в кислороде. Кроме того, легко находится и энтальпия полного сгорания графита (путь 2), т.е. энтальпия образования CO2. Отсюда на основе закона Гесса легко рассчитать энтальпию перехода графита в CO, используя схему:
techemy.com
Термохимические законы и реакции

Энтальпия (теплота) образования— это тепловой эффект реакции образования 1 моль сложного вещества из простых веществ:fH [Дж/моль; кДж/моль]. Обычно в расчетах используют стандартные энтальпии образования.Стандартная энтальпия образованияfH(298 K) это тепловой эффект образования 1 моль сложного вещества из простых веществ при стандартных условиях (T = 298,15 K и p = 101,3 кПа). Стандартные энтальпии образования простых веществ, устойчивых в стандартных условиях (газообразный O2, кристаллический I2и т.д.) принимают равными нулю. Например, окисление водорода можно представить тремя уравнениями:
Каждому уравнению соответствует определенное значение теплового эффекта. И только тепловой эффект реакции, описываемой уравнением (7), будет равен стандартной теплоте образования воды H(298 K)7=fH(298 K, H2O(ж)). Согласно этому уравнению в реакции образуется 1 моль воды, стандартным состоянием которой при 298 K является жидкое.
Для многих веществ стандартные теплоты образования известны и сведены в справочные таблицы (табл. 4.1).
Теплота образования является мерой термодинамической устойчивости (прочности) сложного вещества относительно простых веществ, из которых оно образовано. Можно утверждать, что чем более отрицательное значение имеет стандартная энтальпия образования вещества, тем оно устойчивее. Согласно закону Ломоносова — Лавуазье — Лапласа теплота (энтальпия) образования сложного вещества равна по величине, но противоположна по знаку теплоте (энтальпии) разложения вещества (dH(Т)):
Второе следствие из закона Гесса: тепловой эффект реакции равен сумме энтальпий (теплот) сгорания исходных веществ за вычетом суммы энтальпий (теплот) сгорания продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции.
Так для реакции, протекающей по уравнению:
тепловой эффект можно рассчитать по уравнению:
Энтальпия (теплота) сгорания— это тепловой эффект сгорания 1 моль горючего вещества до продуктов предельного окисления (до образования высших оксидов):cH [Дж/моль, кДж/моль].
Стандартная энтальпия сгоранияcH(298 K) — это тепловой эффект реакции сгорания в кислороде 1 моль данного вещества при стандартных условиях. Например, тепловой эффект реакции сгорания 1 моль метана в стандартных условиях равен стандартной теплоте сгорания метана:
Энтальпии сгорания кислорода и высших оксидов равны нулю. Следует четко разграничивать два различных понятия — энтальпия образования и энтальпия сгорания вещества, хотя численные значения этих величин в некоторых случаях совпадают (табл. 4.1). Например, стандартные энтальпии сгорания водорода и углерода равны стандартным энтальпиям образования CO2и H2O.
studfiles.net
Основные законы термохимии и термохимические расчеты
Во всех химических явлениях выполняется закон сохранения энергии. Соответственно и все законы термохимии являются следствием первого начала термодинамики.
В 1840 г. Г. И. Гесс установил основной закон термохимии: тепловой эффект химической реакции зависит только от начального и конечного состояния реагирующих веществ и не зависит от пути, по которому реакция протекает.
Этот закон также является частным случаем первого начала термодинамики применительно к химическим реакциям, протекающим в изохорных или изобарных условиях.
Так, диоксид углерода можно получить непосредственно, сжигая углерод в кислороде, или же сначала сжигать его до оксида (СО), а затем уже до диоксида углерода.
Эти два пути можно изобразить в виде следующей схемы:
В обоих случаях начальные состояния системы С и О2 и конечное состояние СО2 одинаковы. Суммарные тепловые эффекты равны для первого пути реакции
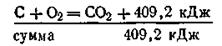
для второго пути реакции
Как видим, тепловой эффект первого процесса равен суммарному тепловому эффекту второго процесса.
Закон Гесса имеет большое практическое применение. Он дает возможность вычислять тепловые эффекты, не проводя химических реакций. Этот закон выполняется также в физиологии и в биохимии. Так, количество теплоты, получаемой от окисления пищевых продуктов в организме в результате целой серии сложных реакций, и количество теплоты, выделяемое при сжигании этих веществ в калориметрической бомбе, оказались тождественными (табл. 1.3).
В табл. 1.3 приведены средние данные, так как различные углеводы, белки и жиры имеют свои индивидуальные особенности, не полностью окисляются в организме и т. д. В качестве продукта неполного окисления белков из организма выделяется мочевина. Именно этим объясняется, что при полном сжигании белка в калориметрической бомбе теплоты выделяется больше, чем при окислении его в живом организме.
В термохимических расчетах часто пользуются следствиями, которые непосредственно вытекают из закона Гесса.
Следствие первое.Количество теплоты, необходимое для разложения сложного вещества на более простые, равно количеству теплоты, выделяющемуся при его образовании из простых веществ (закон Лавуазье — Лапласа).
Так, теплота образования одного моля окиси кальция из кальция и кислорода 634,71 кДж, т. е.
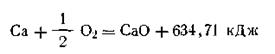
Соответственно для разложения одного моля СаО на кальций и кислород необходимо затратить 634,71 кДж, т. е.
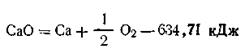
 Закон Лавуазье — Лапласа является частным случаем закона сохранения энергии. Он выполняется при образовании химических соединений из более сложных веществ. Например, теплота образования Li2СО3 из Li2O и СО2 равна
Закон Лавуазье — Лапласа является частным случаем закона сохранения энергии. Он выполняется при образовании химических соединений из более сложных веществ. Например, теплота образования Li2СО3 из Li2O и СО2 равна
226,77 кДж. Для разложения же 1 моль Li2CO3 на исходные оксиды Li2O и СО2 необходимо затратить также 226,77 кДж энергии.
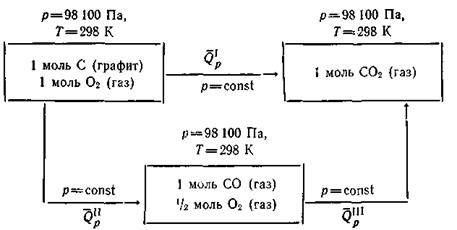
Следствие второе. Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным, то разница между тепловыми эффектами представляет тепловой эффект перехода из одного начального состояния в другое. Это следствие используется в термохимических расчетах. Например, тепловые эффекты при сжигании угля высокой степени чистоты, алмаза и графита до двуокиси углерода следующие:
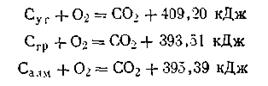
Пользуясь следствием из закона Гесса, можно рассчитать тепловые эффекты перехода из одного аллотропного состояния в другое. Так, при переходе от угля к графиту выделяется 409,20— 393,51 = 15,69 кДж/моль; при переходе от алмаза к графиту — 395,39—393,51 = 1,88 кДж/моль; при переходе от графита к алмазу поглощается 393,51—395,39 =—1,88 кДж/моль.
Следствие третье. Если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным, то разница между их тепловыми эффектами представляет тепловой эффект перехода из одного конечного состояния в другое. Это следствие также используется при расчетах. Например, сжигая углерод и окись углерода до двуокиси углерода, можно опытным путем определить их тепловые эффекты:

Вычитая уравнение (б) из уравнения (а), можно вычислить тепловой эффект реакции сжигания углерода до окиси углерода:
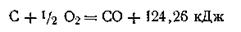
Тепловой эффект этой реакции экспериментальным путем определить очень трудно, потому что невозможно сжечь уголь до окиси углерода без того, чтобы не образовалась частично и двуокись углерода.
Закон Гесса дает возможность определять тепловые эффекты таких реакций, которые или не реализуемы, или не могут быть проведены чисто и до конца. На основании этого закона с термохимическими уравнениями можно производить те же действия, что и с обычными алгебраическими уравнениями. Исходя из этого, только что рассмотренный пример можно записать в следующем виде:
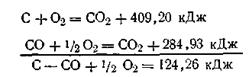
или после перестановки членов уравнения
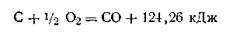
Основным методом определения тепловых эффектов реакции является калориметрический.
Однако, существует и метод, позволяющий определить тепловые эффекты фазовых превращений в механических смесях, а, следовательно, и фазы, которые там находятся.
Качественный фазовый (или термографический) анализ основан на том, что большинство тепловых эффектов, протекающих в веществе, остается неизменным независимо от того, находится взятое вещество в чистом виде или же в смеси с другими солями, если только вещества, входящие в данную смесь, не вступают в химическое взаимодействие. Этот анализ, так же как и идентификация индивидуальных минералов, проводится с использованием эталонных термограмм.
Дата добавления: 2016-02-20 ; просмотров: 752 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
helpiks.org
